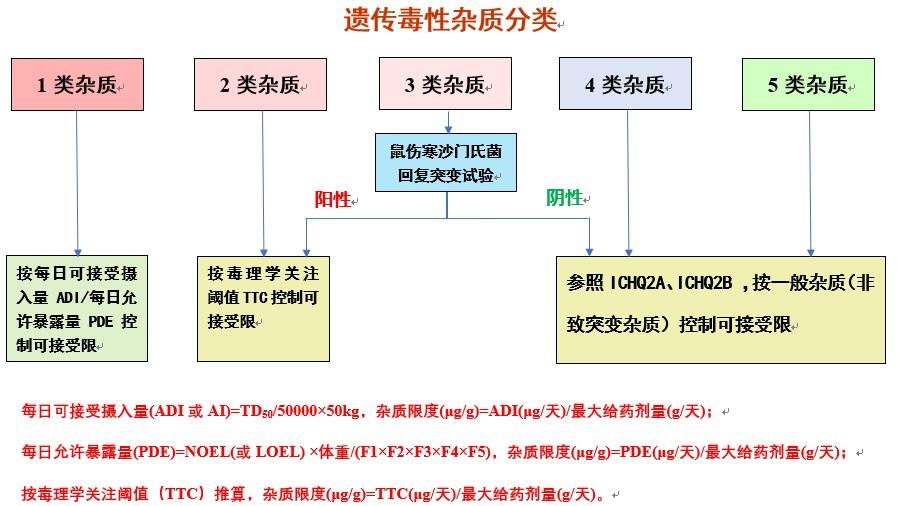
1、遗传毒性杂质的来源及分类
遗传毒性杂质(Genotoxic Impurities,GTIs)主要来源于药物的生产过程,如:起始原料、反应物、催化剂、试剂、溶剂、中间体、副产物、降解产物等,包括致突变性杂质和其它类型的无致突变性杂质。根据杂质是否有致癌性和致突变性(如:细菌回复突变试验是否为阳性、是否含警示结构等),分为5类:
1类:已证明有致突变性和致癌性。
2类:已证明有突变性(细菌致突变试验阳性),致癌性未知(无啮齿动物致癌性数据)。
3类:无致突变性数据,有警示结构,该警示结构与原料药的结构无关。
4类:已证明无致突变性,有警示结构,该警示结构与原料药或其相关物质的结构有关。
5类:无警示结构,或有足够的证据证明该警示结构无致突变性或致癌性。
2、业务范围
根据客户需求,提供遗传毒性杂质分析方法开发、验证及样品检测服务(涵盖起始物料、中间体、原料药、制剂,如:磺酸酯类、N-亚硝胺类等),并配合客户进行分析方法转移。
3、遗传毒性杂质控制策略
4、相关技术要求
ICH M7(R1): Addendum to
M7: Assessment and Control of DNA Reactive (Mutagenic) Impurities in
Pharmaceuticals to Limit Potential Carcinogenic Risk.(评估和控制药物中DNA 反应性(致突变)杂质以限制潜在的致癌风险)(征求意见稿)
ICH Q3A(R2): Impurities
in New Drug Substances.(新型原料药中的杂质问题)。
ICH Q3B(R2): Impurities
in New Drug Products.(新型药品中的杂质问题)。
《中国药典2020年版》四部-<遗传毒性杂质控制指导原则>(第二次征求意见稿)。
