1、业务范围
(1)药物与包材的相容性研究
考察包材与药物之间是否发生影响药品质量的相互作用(如:包材成分迁移、包材对药物的吸附、药物对包材保护功能的影响等),通过选择合适的药包材,确保药品在整个货架期内安全有效、质量可控。
公司开展玻璃、塑料、橡胶、金属等各类包材与药物的相容性研究。
>玻璃类:中硼硅玻璃输液瓶、中硼硅玻璃管制注射剂瓶、中硼硅玻璃安瓿、低硼硅玻璃输液瓶、低硼硅玻璃管制注射剂瓶、低硼硅玻璃安瓿、钠钙玻璃注射液瓶、钠钙玻璃输液瓶、钠钙玻璃管制注射剂瓶等
>塑料类:聚丙烯输液瓶(袋)、低密度聚乙烯输液瓶、多层共挤输液用袋(三层、五层)、口服液体药用聚醋瓶、口服液体药用聚丙烯瓶等
>橡胶类:注射用卤化丁基胶塞、卤化丁基活塞、针头护帽(聚异戊二烯橡胶)、隔垫等
>金属类:不锈钢注射针头
(2)药物与生产工艺组件的相容性研究
考察药物生产过程中使用的设备或工艺组件中的材料成分是否迁移进入药液,或与药物发生相互作用,以评估生产设备或工艺组件引入的安全风险。
公司开展配液桶、管道(不锈钢管道等)、滤材、导管(硅胶等)等生产工艺组件与药物的相容性研究。
(3)药物与输液系统的相容性研究
考察输液过程中,输液装置和给药器械中的材料成分是否迁移进入药液,或与药物发生相互作用,以评估输液装置和给药器械引入的安全风险。
公司开展各类大输液与一次性输液器、一次性注射器配伍时的相容性研究。
2、试验内容
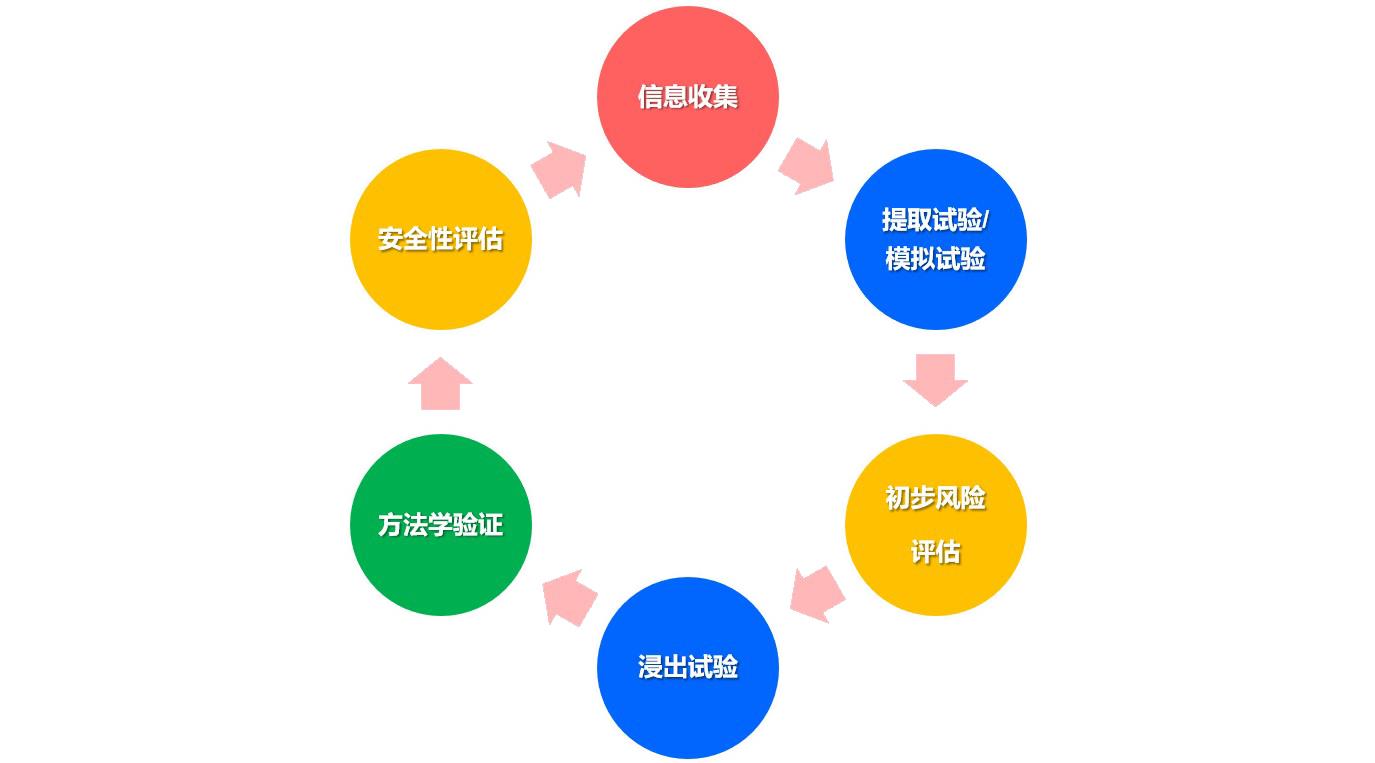
(1)提取研究:用适宜的溶剂,在较剧烈的条件下,对包装组件、生产工艺组件或输液系统进行提取或模拟提取试验。
(2)相互作用研究:包括迁移试验和吸附试验。迁移试验监测从材料中迁移并进入制剂中的物质;吸附试验评价由于吸附而导致的活性成分或功能性辅料含量下降情况。
(3)安全性评估:根据测得的可提取物及浸出物水平,参考毒理学数据库如DEREK, TOXNET, HSDB, TOXLINE等,获得相关物质的最大日暴露量(PDE),将相关物质的每日实际暴露量与PDE进行比较,形成安全评估报告。
(4)相容性结论:根据提取和迁移试验结果,结合毒理学评估,得出是否相容的结论。
3、研究流程
4、相关法规和技术要求
《YBB00142002-2015药品包装材料与药物相容性试验指导原则》
《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》
《中国药典2015版》-9622<药用玻璃材料和容器指导原则>
EMEA:Guideline on Plastic Immediate Packaging Materials(直接接触药品的塑料包装材料指南)
